本文来自Chem-Station日文版 第一手はこれだ!:古典的反応から最新反応まで2 |第7回「有機合成実験テクニック」(リケラボコラボレーション) webmaster
翻译投稿 炸鸡 校对 HaoHu
这次和理学系实验室网站合作,我们会陆续推出十篇的“有机合成实验技巧”特集。
从第六篇开始将持续为期三篇的“合成化学的第一步!:找遍古典反应到最新反应”,手把手教你选择实用型的合成反应条件。我们在上一回中学习了如何选择合适的氧化反应。今天给大家带来的是有机合成中经常会用到的保护基和缩合反应。
保护基的选择:在什么反应条件下用什么保护哪些基团?
保护基,顾名思义,就是“保护我们不想参与反应的部分”的取代基。如果把反应分子比作一个人的话,这个人现在正在遭受各种各样的攻击,而保护基就相当于保护用具,我们需要考虑保护用具应该放在身体的哪个部位呢,该使用哪些保护用具呢,怎么穿上保护用具呢,。。。。等等一系列的问题。
那么让我们一起愉快地进入正题吧!想了解更多关于保护基的同学们可以参考本网站的文章“谈谈那些年深爱过的保护基”。
因为需要保护的基团种类和保护基团的种类过于庞大,所以我们这里不做讨论。先说说我们首要考虑的:首选的反应条件(即怎么穿上保护用具呢)。因为比起导入保护基脱下保护基更重要,所以在讲完反应条件后我们会谈谈如何选择合适的反应条件脱下保护基(即脱下保护用具)。
烷基硅类保护基的导入•脱除方法
烷基硅类保护基在保护醇方面一直是备受广大实验工作者的喜爱。我们网站的醇的硅醚保护反应 Silyl Protective Group这一篇文章每年都是点击率最高的文章之一。理由很简单:烷基硅类保护基引入和脱下都很简单。
烷基硅类保护基根据保护基体积大小的不同有很多种类,其中最常用的是TBS(叔丁基二甲基硅基)。首选的反应条件为TBSCl,咪唑和DMF。这个反应条件成本最低,反应时只需要将TBSCl固体投入进反应溶液即可,而且TBS基团几乎能保护所有类型的醇。如果你不想使用DMF作为溶剂或者需要比较温和一点的反应条件(或者需要保护的醇体积太大),反应条件可以变更为TBSCl,NEt3 (DMAP),CH2Cl2。如果在这样的反应条件里,TBSCl和醇的反应太慢或是保护效果不明显,可以改用TBSOTf,2,6-二甲基砒啶和CH2Cl2。TBSOTf比TBSCl稍微昂贵一点,但是因为TBSOTf与醇的反应活性更高,所以它也能保护一些体积较大的醇。比如我们需要对叔醇t-BuOH进行保护,如果用TBSCl,咪唑和DMF的话,即使反应了3天,反应收率连一半也达不到,但是如果用TBSOTf,2,6-二甲基砒啶和CH2Cl2的话,10分钟就能反应完得到定量的反应产物。这些规则不仅适用于TBS保护基还适用于所有的烷基硅类保护基。
有“穿上”就有“脱下”。烷基硅类保护基的脱除方法首选TBAF,THF或是HCl (or AcOH),THF/H2O。根据化合物酸碱性的强弱选择不同的脱除方法。比如化合物酸性很强,就要用盐酸来脱除保护基。如果反应进行不下去可以加热反应体系来帮助反应进行。
如果化合物不耐酸,就要使用TBAF和THF。这种方法利用了硅元素和氟元素之间的亲和性来有效去保护基。但是这种方法有一个缺点,就是在去保护基的过程中,会生成醇盐,如果原化合物的耐碱性不是很强的话会导致原化合物被分解。这时候,就要请出特别嘉宾:醋酸(AcOH)。添加等量的醋酸,体系内生成的醇盐就会立刻被醋酸质子化,就能防止碱性环境下化合物被分解。
温和的烷基硅类类保护基的导入•脱除方法
在此之前我们介绍的都是一些基本的条件。但是这一小节中我们将介绍一些反应条件比较苛刻的方法供土豪们和感兴趣的同学们选择。我个人非常喜欢R3Si–CN。因为你只需要“一锅炖”就可以了,其他的也不需要管了,甚至不需要溶剂。但上TMS保护基的时候要注意将醇和适量的TMSCN混合在一起,多余的TMSCN要用减压蒸馏除去。但是要注意如果有HCN生成或者反应体系中有反应活性很高的酮,就会发生烷基硅氰基化反应。
另外,如果需要的反应条件较强,需要反应体系PH值呈中性的话,我推荐你使用关西学院大学的田边课题组开发的Si-BEZA。仅限于TMS、TES基等比TBS基反应活性弱的保护基的话,又想让整个反应体系呈中性,我个人强烈推荐4-三烷基硅氧烷-3-戊烯-2-酮。反应要用反应活性较高的醇否则反应不会发生,加入4-三烷基硅氧烷-3-戊烯-2-酮后整个反应体系呈中性。
4-三烷基硅氧烷-3-戊烯-2-酮
关于去保护基的方法,如果是1级TBS基的话,像TES基之类的推荐使用LiBF4和CH3CN溶液。LiBF4固体价格低廉所以就放心大胆的加吧~虽然没有用DMF做溶剂但是CH3CN作溶剂能溶解一些极性非常高的化合物。还有一个我虽然没怎么用但还是情有独钟的方法——过量的NH4F和MeOH。HF和吡啶虽然可以在接近中性的条件下脱除保护基,但是如果反应规模较大的话,反应会很麻烦而且后处理繁琐。NH4F作为一种便宜且性质稳定的盐即使大量加入也不会有问题。还有一种方法就是用硅酸盐——TASF,这种方法也曾流行一时,但最近好像不怎么看到了,可能是成本太贵了吧。
再讲讲如何选择烷基硅类保护基。如果你需要长时间的保护建议你使用强大的保护基(TIPS基和TBDPS基)。TBS基容易脱落而且脱除比较麻烦所以不是很推荐啦。我还是学生的时候因为听说TBDPSCl很贵所以一直不敢用,所以保护伯醇我用TBS基,保护仲醇我用TES基,结果都不能完美地分离,不得不重做了。。。。
不知不觉我已经讲了这么多了,光讲烷基硅类保护基已经写了这么多了。想了解经常使用的苯基类和酰类,还有保护氮的,羧基类保护基等的基本反应条件的可以在本网站里搜索相关文章。
脱水缩合反应的首选:首先从最基本的反应条件试起吧
这一小节里我给大家带来缩合反应的首选。狭义上的缩合反应一般指羧酸和醇或胺反应生成酯和酰胺的一类反应。理想情况下反应会生成副产物——水,所以为了高效率地,温和反应条件下去除生成的水,一系列各种各样缩合反应和缩合剂被开发出来。
首先我们要考虑的是“化合物对酸和碱稳定吗”。
比如简单结构的羧酸和醇反应的话,最廉价的,最优的反应条件就是教科书上告诉我们的:把羧酸,醇,酸催化剂(HCl)以及甲苯溶液共沸,用Dean-Stark之类的玻璃仪器来不断移除反应中生成的水。如果羧酸非常不活泼的话,可以用氯化亚砜或乙二酰氯和羧酸反应使羧酸转变为酰基氯,再加入仲胺缩合,这是一种既便宜又反应性高的方法。当然,使用昂贵的缩合剂也不是什么坏事,但首先试试这个便宜的方法,如果不行的话再用昂贵的缩合剂也不迟。
如果羧酸比较不活泼,可以和无水酸酐反应和或者2,4,6-三氯苯甲酰氯反应活化羧酸。如果这样还是不行的话,建议亲用缩合剂吧
不稳定化合物的缩合反应
这里的不稳定化合物是指遇酸和碱就会分解的化合物。“氨基酸缩合”是我们熟悉的一种生成酰胺键的缩合反应。氨基酸缩合的时候,不对称中心经常发生消旋化。大多数情况都是由于反应能量过大导致消旋,一般都是发生在反应的某一步中间体上。
先不讨论消旋化了。让我们来想想什么缩合剂能促进不稳定化合物的缩合呢?第一选择当然是EDC(1-乙基-(3-二甲基氨基丙基)碳酰二亚胺)。可以使用大学课上讲过的DCC(N,N’-二环己基碳二亚胺),但DCC通常像石头一样硬,因此在反应前很难进行精确的称量(估计只有过来人才能理解其中的辛酸吧),而且除去反应副产物二环己基脲也极其麻烦。而使用EDC就没有这样的烦恼了,因为实际和副产物存在于水相中,所以只需分液即可得到产物。如果担心发生消旋化的话可以加入等量的HOBt或者HOAt。HOBt和HOAt起着所谓的“媒介作用”,在不影响羧酸和胺的前提下,促进缩合反应进行。
还有一种缩合剂——DMT-MM,它能溶于水和乙醇。即使在水或者甲醇作为溶剂的反应体系中也能顺利推进酰胺化反应的进行。
限于篇幅,弱碱性缩合剂只能暂且不讲了。
使用高性能缩合剂提高反应效率的缩合反应
如果你不计金钱也要得到目标化合物的话,请试试最新的高能缩合剂吧。强烈推荐HATU(2-(7-氮杂苯并三氮唑)-N,N,N’,N’-四甲基脲六氟磷酸酯)。很多缩合反应都用这种缩合剂提高缩合效率。因为反应体系中会生成HOAt,所以我们不必担心会发生消旋化。另外,对于有些体积庞大且反应活性极差的羧酸和胺,用BOP-Cl反应剂可以促进反应的发生,但是由于其致癌性目前已经停产了。因为最近我没怎么做有难度的酰胺缩合反应,所以对这一块了解并不是很多,抱歉。
使用了HATU的缩合反应(出处:Wikipedia[HATU]を改変)
注:虽然我上文说了HATU价格比较昂贵,但25g的HATU价格约在23,00到30,000(rmb约在1380~1800之间)日元之间。25g的EDC约为20,000日元(rmb1200),其实也差不太多。如果考虑到添加HOBt和HOAt来消旋的话,高性能缩合剂似乎更划算。但是不管怎么说,和传统的方法比,成本还是很高的。
介绍了两个应用范围很广的反应
抱着想给大家讲讲合成化学中如何选择反应方法,但很遗憾本系列(合成化学的第一步!:找遍古典反应到最新反应)预订只有3篇,下一篇就是本系列最后一篇了。最后一篇将带大家学习交叉偶联反应的选择。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
概要
2,2,2-三氯乙氧基羰基保护基(2,2,2-trichloroethoxycarbonyl, Troc)、它经常用于通过形成氨基甲酸酯来保护胺基。在某些情况下,它还用于酒精和苯酚上羟基的保护基。
对于强碱条件下的酯水解条件・强酸性条件・亲核条件・弱的氢化物的还原条件耐受性好,脱保护通常在锌-醋酸的单电子还原条件下进行。
基本文献
- Windholz, T. B.; Johnston, D. B. R. Tetrahedron Lett. 1967, 8, 2555. doi:10.1016/S0040-4039(00)70346-7
- Carson, J. F. Synthesis 1981, 268. doi:10.1055/s-1981-29408
- Just, G.; Grozinger, K. Synthesis 1976, 457. DOI: 10.1055/s-1976-24080
反应机理
保护
2,2,2-三氯乙基氯甲酸酯(Troc-Cl)常用作反应试剂。加入吡啶或三乙胺作为碱并与胺反应。对于氨基酸的保护等,使用无机碱的Schotten-Baumann条件也很常见。

脱保护
在还原条件下使用锌粉 – 乙酸进行脱保护是常见的。 副产物为挥发性1,1-二氯乙烯和二氧化碳。

反応例
在许多保护基团存在下,可以选择性地除去Troc[1]。

参考文献
- Bergeron, R. J.; McManis, J. S. J. Org. Chem. 1988, 53, 3108–3111. DOI: 10.1021/jo00248a037
关联书籍(日亚价格)
Greene’s Protective Groups in Organic Synthesis
- 著者Peter G. M. Wuts
- 参考価格¥ 12,342日元
- 出版社John Wiley & Sons Inc
概要
1,2-二醇以及1,3-二醇通常以形成5元环或者6元环化合物的方式进行保护,这也是比较常规的手法。
关联反应(本网站)
- Protection of Carboxylic Acid
- Protection of Carbonyl Group
- Ether Synthesis by Reduction of Acetal
- Acyl Protective Group
- Acetal Protective Group
- Ether Protective Group
- Carbamate Protection
- p-Methoxybenzyl (PMB) Protective Group
- Silyl Protective Group
- 谈谈那些年深爱过的保护基
基本文献
- Ley, S. V.; Baeschlin, D. K.; Dixon, D. J.; Foster, A. C.; Ince,S. J.; Priepke, H. W. M.; Reynolds, D. J. Chem. Rev. 2001,101, 53. DOI: 10.1021/cr990101j
反应机理
反应实例
D-Mannitol的选择性保护[1]

选择性保护甲基葡萄糖[2]

实验步骤
实验技巧
以下所示的保护基是比较常用的几种。亚苄基缩醛为6元环,二甲基缩醛为5元环都是在热力学上比较优先形成的。通过利用这一点,可以如反应例中那样选择性地保护多元醇化合物。

缩醛保护基团在碱/还原条件下是稳定的并且可以用酸去保护。碳酸盐保护基相反在碱性条件下脱保护。 甲硅烷基型保护基通常用氟源去保护。
参考文献
[1] Schmid, C. R.; Bryant, J. D. Org. Synth. 1995, 72, 6.[2] Ferro, V.; Mocerino, M.; Stick, R. V.; Tilbrook, D. M. G. Aust. J. Chem. 1988, 41, 813.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
本系列内容是为帮助大家能够直面全合成中应克服的困难而编写的。列举了一些在全合成过程中遇到的棘手问题的解决方案,采用了小问答的形式介绍给大家。
第9回小编准备介绍下、Andreas Pfaltz与铃木 启介(Suzuki Keisuke)等人的Macrocidin A的全合成(2010)。
往期内容回顾请戳我~
第九回 问题
该篇的原文献如下所示
“Total Synthesis and Absolute Configuration of Macrocidin A, a Cyclophane Tetramic Acid Natural Product”
Yoshinari, T.; Ohmori, K.; Schrems, M. G.; Pfaltz, A.; Suzuki, K. Angew. Chem. Int. Ed. 2010, 49, 881. DOI: 10.1002/anie.200906362
一般来说环化反应难以进行的原因大致是,反应性不够,其他的副反应更快,或者构象限制等。这回终盘运用到类似Dieckmannh环化反应,为了合成目标的大环骨架的结构,而反应没有顺利进行,很大的可能就是由于构象限制。
从原料的单晶结构解析[1]可以看出,两个反应位点(活性亚甲基的碳与酯基的羰基碳)离的很远,并且呈s-trans构象。这是环化反应无法顺利进行的原因。因此,才有了在酰胺上加一个保护基团,使得其整个构型变成s-cis,这样两个反应位点就能充分接近。

另外,众所周知N-取代后的酰胺具有cis,trans两种异构体,而2级酰胺的话基本上以热稳定性更强的s-trans体为主(立体位阻小)。但是三级酰胺的话,两个构型上立体位阻的差就变得很小了(例如N-酰基脯氨酸,两种构想只有3~4 kJ/mol的能量差),因此3级酰胺相比于2级酰胺,s-cis构象是主要构型。

按照这个策略的话,理论上任何保护基都是可以达到目的的,然而这里作者却用了p-叠氮基苯[2]这个不常见的保护基团,同时如问题中所述,如果采用这个保护基,接下来还需要经历①叠氮→胺基(or亚氨基膦)的还原 ②氧化 这两步才能脱保护,从推测来看应该不是最优先考虑的保护基团。
而这次,其实是由于原料中具有不耐酸的环氧环,富电子的芳香环,反应性高的tetramic acid等部位,因此如果保护基采用Bn, PMB等脱保护条件是酸性的话,那些原料中的不耐酸基团都得悲剧。所以,才最终选择了在温和氧化条件下就就能除去的PAB基团。

这次你答对了么?
相关文献
- CCDC 756980
- Fukase, K.; Hashida, M.; Kusumoto, S. Tetrahedron Lett. 1991, 32, 3557. doi:10.1016/0040-4039(91)80832-Q
外部链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
本系列内容是为帮助大家能够直面全合成中应克服的困难而编写的。列举了一些在全合成过程中遇到的棘手问题的解决方案,采用了小问答的形式介绍给大家。
第9回小编准备介绍下、Andreas Pfaltz与铃木 启介(Suzuki Keisuke)等人的Macrocidin A的全合成(2010)。
往期内容回顾请戳我~
合成终盘作者运用了Dieckmannh环化反应,然而看似非常顺利的设计,缺没有得到目标产物。然后,作者改变路线,用p-叠氮苯(PAB)基对酰胺基团进行保护、最终环化反应得以成功进行。请详细说明这里PAB基的作用。另外考虑下为啥没有使用类似构造的保护基(苄基或p-甲氧基苄基)。
解答会在之后公开,请大家先思考一下~
关联书籍
Dead Ends and Detours
- 作者Miguel A. Sierra,Maria C. de la Torre
- 参考价格¥ 12,317
价格¥ 9,743(2016/11/11 23:36) - 出版日2004/12/27
- 商品排位5,224位
- 页码数290页
- ISBN-103527306447
- ISBN-139783527306442
- 出版社Wiley-VCH
More Dead Ends and Detours
- 作者Miguel A. Sierra,Maria de la Torre,Fernando P. Cossio
- 参考价格¥ 11,348
价格¥ 8,836(2016/11/12 10:31時点) - 出版日2013/05/22
- 商品排位7,761位
- 页码数288页
- ISBN-103527329765
- ISBN-139783527329762
- 出版社Wiley-VCH
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
概要
硼酸化合物一般来说对酸、水稳定,而且结晶性也比较好,是一个取用十分简便的试剂。硼酸化合物作为铃木偶联等的底物而备受关注。但是,无保护的硼酸化合物的纯化比较困难,而且容易脱水三聚化,因此定量比较繁琐,同时,有些硼酸化合物对酸或者氧化剂等不稳定,因此常常我们使用的是保护后的硼酸化合物。
常用硼酸保护基实例
经常使用的保护基有以下几种。很多情况下是与二醇反应形成环状酯基来进行对硼酸的保护。随着二醇的立体位阻增大,其被水解的难度也变大,也就更稳定。与单醇成非环状酯的反应通常不作为保护的目的。

- 频哪醇酯(pin):最受欢迎的保护基。可以通过宮浦硼基化反应、Hartwig-Miyaura C-H硼基化反应等简单的合成制备。保护后的底物反应性适中,可以在氧化条件下转换成醇,另外最主要的是可以直接用作铃木偶联的底物。该保护后的产物可以通过过柱子分离纯化。但是由于过于稳定,所以无法通过水解脱保护成硼酸再转换成其他保护基保护的硼酸酯化合物。
- 二氨基萘酰胺(dan):对各种条件都具有很强的耐受性的保护基。由于邻位的氮原子的电子对硼的空轨道有一个供电子效应,所以该化合物的路易斯酸性与反应性都非常低。
- MIDA硼酸酯:不存在空轨道,因此对各种氧化条件・酸性条件・还原条件具有很强耐受性。可以用硅胶柱直接分离纯化。制备过程中需要在DMSO中加热脱水,并且还要蒸馏除去溶剂,操作麻烦是其最大的缺点。
- 三氟硼酸盐:具有很高的结晶性。由于带有吸电性的氟原子,并且没有空轨道的存在所以对氧化条件稳定。有机溶剂中的溶解性比较低。
其他的如邻苯二酚酯(cat)、新戊二醇酯(neo)、不易水解的蒎酯、Biscyclohexyldiol酯、氧化条件下脱保护的MPMP酯、对三氟硼酸盐的缺点进行改良后的三醇硼酸盐等也可以作为候补。
基本文献
<Review>
- Duggan, P. J.; Tyndall, E. M. J. Chem. Soc. Perkin Trans. 1 2002, 1325. DOI: 10.1039/B006767I
- Lennox, A. J. J.; Lloyd-Jones, G. C. Isr. J. Chem. 2010, 50, 664. DOI: 10.1002/ijch.201000074
- Lennox, A. J. J.; Lloyd-Jones, G. C. Chem. Soc. Rev. 2014, 43, 412. DOI: 10.1039/C3CS60197H
- Xu, L.; Zhang, S.; Li, P. Chem. Soc. Rev. 2015, 44, 8848. DOI: 10.1039/C5CS00338E
<diaminonaphthalene>
- Noguchi, H.; Hojo, K.; Suginome, M. J. Am. Chem. Soc. 2007, 129, 758. DOI: 10.1021/ja067975p
<MPMP diol ester>
- Yan, J.; Jin, S.; Wang, B. Tetrahedron Lett. 2005, 46, 8503. doi:10.1016/j.tetlet.2005.10.010
<MIDA boronate>
- Gillis, E. P.; Burke, M. D. J. Am. Chem. Soc. 2007, 129, 6716. DOI: 10.1021/ja0716204
- Li, J.; Grillo, A. S; Burke, M. D. Acc. Chem. Res. 2015, 48, 2297. DOI:10.1021/acs.accounts.5b00128
<trifluoroborate>
- Vedejs, E.; Chapman, R. W.; Fields, S. C.; Lin, S.; Schrimpf, M. R. J. Org. Chem. 1995, 60, 3020. DOI: 10.1021/jo00115a016
- Darses, S.; Genet, J.-P. Chem. Rev. 2008, 108, 288. DOI: 10.1021/cr0509758
<cyclic triolborate>
- Yamamoto, Y.; Takizawa, M.; Yu, X.-Q,; Miyaura, N. Angew. Chem. Int. Ed. 2008, 47, 928. DOI:10.1002/anie.200704162
脱保护条件
频哪醇酯的脱保护条件[1]: 比较稳定,一般的水解条件进行脱保护比较困难,经常需要酸性・加热条件双管齐下才能达成。生成的频哪醇再通过过碘酸钠分解,或者苯基硼酸捕捉等方法也经常被采用。另外先转换成三氟硼酸盐再转化成硼酸,或者先变成氨基酯型的硼酸盐再变成硼酸的方法比较温和,也是很常用的脱保护手法。具体请看下图所示实例。

dan基的脱保护[2]:脱保护后拖去的二胺基萘通过酸性溶液萃取就可以很容易的除去。

MIDA酯的脱保护[3]:碱性水溶液下就能简便的脱保护。该保护基对其他条件都比较稳定。

硼酸保护体的相互变换[4]

实验技巧
硼酸频哪醇酯在精制的时候,混有硼酸的硅胶柱可以提高分离效果[5]。
参考文献
- (a, b) Coutts, S. J.; Adams, J.; Krolikowski, D.; Show, R. J. Tetrahedron Lett. 1994, 35, 5109. doi:10.1016/S0040-4039(00)77040-7 (c) Sun, J.; Perfetti, J. S.; Santos, W. L. J. Org. Chem. 2011, 76, 3571. DOI: 10.1021/jo200250y (d) Yuen, A. K. L.; Hutton ,C. A. Tetrahedron Lett. 2005, 46, 7899. doi:10.1016/j.tetlet.2005.09.101
- Noguchi, H.; Hojo, K.; Suginome, M. J. Am. Chem. Soc. 2007, 129, 758. DOI: 10.1021/ja067975p
- Gillis, E. P.; Burke, M. D. J. Am. Chem. Soc. 2007, 129, 6716. DOI: 10.1021/ja0716204
- Churches, Q. I.; Hooper, J. F.; Hutton, C. A. J. Org. Chem. 2015, 80, 5428. DOI:10.1021/acs.joc.5b00182
- Hitosugi, S.; Tanimoto, D.; Nakanishi, W.; Isobe, H. Chem. Lett. 2012, 41, 972. doi:10.1246/cl.2012.972
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
本系列内容是为帮助大家能够直面全合成中应克服的困难而编写的。列举了一些在全合成过程中遇到的棘手问题的解决方案,采用了小问答的形式介绍给大家。
第六回介绍的是柴崎正勝・金井求在2005年达成的Garsubellin A全合成。在抑制副反应上真的是下了些功夫。一起来看看吧。问题请戳我。
Total Synthesis of (+/-)-Garsubellin A.
Kuramochi, A.; Usuda, H.; Yamatsugu, K.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc.2005, 127, 14200. DOI: 10.1021/ja055301t
解答例
首先我们先来揣测一下此反应的意图.
和最终结构对照一下可以发现,需要向二环骨架中导入碳链。可以先对1,3-二酮进行烯醇化后,然后再与比较soft的碘化烯丙基化合物通过亲核反应进行导入。But!想要发生这一反应的目标碳原子周围位阻很大,于是反应停留在O-烷基化反应。如果你读了论文就会知道,作者之后采用了Claisen重排,得到了想要的C-烷基化反应产物。

不管怎么说,像本文中的这种亲核碳骨架伸长的反应都需要在强碱性条件下完成 烯醇化物→烷基化反应这条路。而该反应成功的关键在于必须要用到下面问题中提到的红字所示的反应试剂。

首先,先考虑一下分子筛4A(MS4A)的作用。不考虑特殊情况的话,一般在有机合成上它都是用作干燥剂。也就是说条件中不能有水存在,那我们就可以推测出来,这里会有水出现,所以加了分子筛。
有水,并且还是在NaHMDS这一强碱性条件下・・・这好似就是NaOH的生成条件呀。
话说,有能发生反应的部位么・・・发现一个。左边有一个二醇保护基。我们可以推测,「收率较低」的原因是不是就是因为这个部位和NaOH发生了反应,损失了一部分呢。

走到这里也就看到了曙光,另一个添加剂碳酸乙烯酯。它与盐酸盐保护基部位结构很是相似,也就是在反应中它作为一种Dummy Compound,充当了代替盐酸盐与NaOH发生反应的作用。由此抑制副反应的发生,提高了最后的收率。

怎么样,这一期的问题你已经顺利解决了吗?敬请期待第7问的面世吧!
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
本系列内容是为帮助大家能够直面全合成中应克服的困难而编写的。列举了一些在全合成过程中遇到的棘手问题的解决方案,采用了小问答的形式介绍给大家。
本期介绍的合成问题来自Sturmer・Hoffmann等人在1993年达成的Erythronolide类似物的全合成。
A Short, Linear Synthesis of (9S)-Dihydroerythronolide A
Stürmer, R.; Ritter, K.; Hoffmann, R. W. Angew. Chem. Int. Ed.1993, 32, 101. DOI: 10.1002/anie.199301011
前期回顾
第五回 问题
解答例
此次和第三回的问题类似,最后的脱保护没有顺利完成,也就是脱保护基的问题。
合成的最终步骤是希望能在较为温和的条件下去保护,一般情况下回慎重选择保护基。但是本次合成基本都是在同样酸性条件下可以去保护的2个缩醛,也就把这条路线留到了最后。目标化合物看上去能顺利脱保护,但实际上可能从开始的想法上就隐藏了棘手的问题。
反正到全合成之前这条路都走得很完美,只要托保护基问题解决了就搞定了。
本期论文的作者是如何解决这一棘手的问题的呢。
正如问题中所述,最终因为盐酸水溶液这一酸性条件,保护基脱落,在这一步想达成保护基的选择性脱去的话就必须只要PMP缩醛对酸性水解具有耐抗性。
・・・这能办到么,猛地一看还真是吓一跳,加入了三硝基甲苯以后具有有这样的效果!
作为化学狗,大家肯定知道TNT是个什么东西。那个威力十足的炸药呀。
TNT爆炸模拟视频↑
这玩意市面上能有卖的?!一瞬间小编我也是报以怀疑的态度的。不过,实际查查就能知道了。这东西还真是……你敢卖我就敢买买来就能用上一用。
购入了这么一个除了能当炸药用以为别无它用的试剂,说实在的从反应开发上来讲有点难以置信,但是从化学观点上看的话,也算合理吧。
虽然同样是缩醛,但是PMP缩醛和环松油烯缩醛(cyclypentylideneacetal)有一个不同点,那就是PMP缩醛含富电子芳香环而环松油烯缩醛则没有这一特点。而TNT,具有3个硝基是缺点子的芳香族化合物。
欸,等等,这样的话是不是就是π-π相互作用的原理呀。
是的!实际上就是通过TNT和PMP的π-π相互间作用,形成电荷移动配合物。如此一来,PMP缩醛就显正电性,从而抑制了因为形成氧鎓离子的开环,继而也就不会引发水解反应。

而另一方面,环松油烯缩醛(cyclypentylideneacetal)一边,由于不会发生相互作用,照常发生酸催化的水解反应。于是就达到了最后选择性脱保护基的目的!
不知道如何是好的时候,拿起试剂试上一试,可能还有有意想不到的效果的说。搞不好,还能创出一个新化学反应也说不定哈。呵呵呵 少年你真是年轻呀。。。。遗憾的是现实总是残酷的OTL
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
合成具有多个官能团的化合物时,只希望让其中某一个官能团发生反应的例子很常见。
例如图1中所示,反应物中有3个羟基,但是希望其中一个氧化成醛基。如果只是按照直接氧化的话,其他两个羟基必定也会发生反应,这可怎么是好。

图1 想选择性进行氧化时
这个时候就按照图2蓝色部分所示,转换成醚键或者酯基这样的不易被氧化的官能团。

图2 选择性进行反应
基于这种目的时使用的,可以再通过反应脱去的官能团被称为保护基(Protecting group)。今天就简单介绍一下保护基。
保护基的性质
保护基正如上面所说到的,是一种通过特定的化学反应将官能团保护起来(提高其稳定性)为主要目的的基团。根据目的使原部位化学性质稳定,开发了各种各样的保护基。
此外,还有像下面要介绍的一些功能。
①提高溶解性降低极性:糖、氨基酸经常被用于合成起点。但是,这样的化合物极性较高,,大多数不溶于有机溶剂中,一部分溶于水中造成收成很低的结果。此时通过保护极性官能团就能够改善这一点。
②提高结晶性:精制合成中间体的时候,特别是扩大反应的情况下会希望尽可能避开过柱子。此时可通过重结晶的方法来选择合适的保护基,提高结晶的形成。如果能得到单晶的话通过X射线得到3次元结构的话从分析的观点上来说也是极为重要的。这里面常用到的就是−Br、−NO2或者带有方向官能团的开进行保护。
③生物活性的变化:生理活性物质中因为极性官能团作用使生物体高分子间发生相互作用的例子很多。通过导入保护基能够屏蔽下极性官能团,使生物活性降低。
④ 挥发性的变化:通过导入保护基、分子量变大、沸点升高。由此可以通过减压旋蒸简便地除去溶剂更容易干燥。除此以外,将羟基转化为甲醚或R−O−TMS等,分子量增加的同时极性也降低,其结果是增加了挥发性。这样的话,在质量分析或GC时更容易一些。
⑤使构造解析更容易:原本没有UV吸收带的化学物上加一个强UV吸收性的保护基的话可以提高在HPLC中的高感度检测。
⑥反应性的改变:使用立体位阻较大的保护基来可以遮住其附近的反应性,利用配位性保护基进行化学选择性反应
保护基中的代表
作为保护基不仅要容易上保护还必要要具备容易脱保护的性质。最终产物无法脱保护的例子在实际合成案例中很多,如果最后不能顺利脱去的话,保护基也就失去了意义。
为了达到反应目的,不断开发出了各种各样的保护基,为了保证反应的进行我们有必要掌握它们各自的特点,要根据实际情况合理选择使用。
表1中列举了羟基被保护时几种代表保护基的简称以及脱保护条件。其他的保护基类型大家可以通过平时的论文积累进行总结,也可以多多利用化学空间的反应百科。
| 结构 | 名称(简称) | 脱保护条件 |
| | Benzyl苄基 (Bn) | ・H2,Pd/C ・Na/NH3 等 |
| | 4-Methoxyphenylacetone 对甲基苄基醚(PMB or MPM) | ・和Bn一样 ・使用DDQ,氧化条件 |
| | Methoxymethyl group甲氧基甲醚 (MOM) | ・HCl/MeOH等酸性溶剂进行分解 ・MeBBr2 等 |
| | Trimethylsilyl group 三甲基硅氧醚 (TMS) | ・AcOH/H2O/THF等酸性加水分解 ・TBAF、HF-Py等氟离子 |
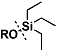 | Triethylsilyl group 三乙基硅氧醚(TES) | |
| | tert-butyldimethylsilyl group (TBS) | |
| | Acetyl group 乙酰基(Ac) | ・碱性条件下加水分解 ・DIBAL・LAH还原等 |
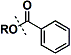 | Benzoyl苯甲酰基(Bz) | |
| | Trityl group 三苯甲基咪 (Tr) | ・酸性加水分解等 |
表1:羟基类代表性保护基
实际反应例
根据不同的论文,来看看保护基的使用例和脱保护的条件。
图3中的例子1)是将MPM基团去除2)是将TBS基团导入
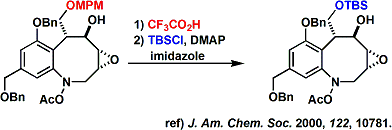
图3
图4中,不同条件下上TBS保护的不同情况
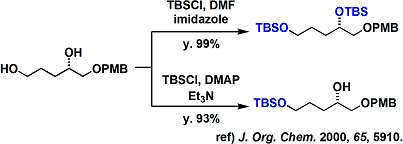
图4
图5中1)用乙酰基进行保护2)除去MEM基团。反应计划是除去MEM基团后,通过曾被保护的羟基进行光延反再进行重排反应。为此第一步的乙酰基保护就很重要了。

图5
结束语
上面为大家介绍的内容想必在平时的实验中都有些切身体会吧。保护基需要上保护和脱保护两个必要环节,也就意味着需要多个反应工程。但是对于现代有机合成来讲是不可缺少的环节。最近几年多有关于将保护基赋予其他活性在反应中兼并发挥保护之外的职能类的发表不断出现。借此机会一起多来学习学习保护基的县相关知识吧。
相关书籍
[amazonjs asin=”B01AULQ8X6″ locale=”CN” title=”有机合成中的保护基(原著第五版)-羟基(含1,2-二醇, 1,3-二醇)的保护”]相关链接
- Protecting Group (Wikipedia)
- Protecting Groups (organic-chemistry.org)
- Protecting Groups – Stability (organic-chemistry.org)
- Protecting Groups
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
- 概要
一般我们会把1,2-二醇或是1,3-二醇很容易的变成五元环或是六元环的形态从而把它们保护起来。
- 基本文献
・Ley, S. V.; Baeschlin, D. K.; Dixon, D. J.; Foster, A. C.; Ince, S. J.; Priepke, H. W. M.; Reynolds, D. J. Chem. Rev. 2001, 101, 53. DOI: 10.1021/cr990101j
- 反应机理
- 反应实例
D-Mannitol的选择性保护[1]
甲基葡萄糖的选择性保护[2]
- 实验步骤
- 实验技巧
最常用的有以下几种保护基。由热力学的稳定性一般倾向于生成六元环的苄基缩醛、五元环的二甲基缩醛。利用这一点就能像反应例子里一样选择性的对多元醇进行保护了。
缩醛保护基团在碱性,还原性条件下稳定,一般用酸来脱保护。相反碳酸酯保护基用碱性条件下脱保护。硅元素系保护基一般用氟化物来脱保护。
- 参考文献











